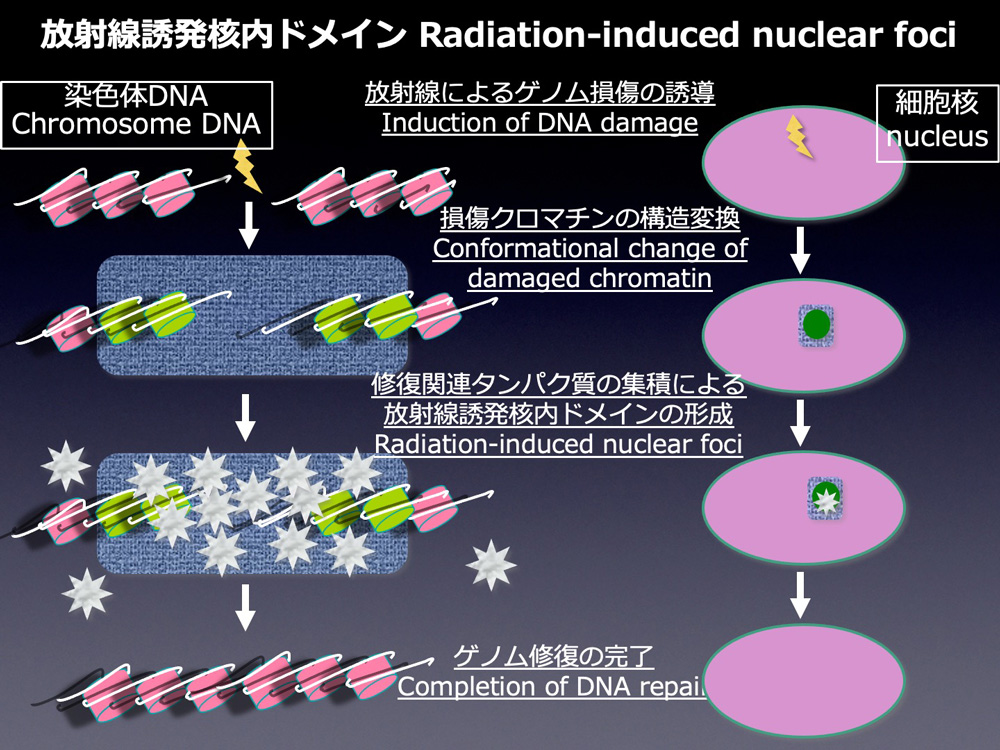
放射線誘発核内ドメインとは?
従来、教科書には核内の構造物としては唯一核小体が記載され、染色体DNAの分布密度が高いところはヘテロクロマチン、低いところはユウクロマチンとして描かれてきました。しかし、近年のDNAおよび蛋白質の可視化技術や画像解析技術の進歩は、細胞核が予想以上に整然とした構造構築を持つことを明らかにしました。DNAが染色体として観察される細胞分裂期以外の球形をした細胞核の中でも、染色体DNAは混ざりあっておらず、染色体別に染色体領域(chromosome territories)と呼ばれる領域を形成していることが明らかになりました。また、細胞核の中に存在する様々な蛋白質も点状、網状などの分布を示し、特定の領域に集積し核内ドメインと呼ばれる高次構造体を形成していることが明らかになりました。このような核高次構造は、染色体DNAの複製、転写および修復などの化学反応の「場」と密接な関連があると考えられています。
放射線被ばくした細胞では、DNAの修復に関わる様々なタンパク質がゲノム損傷部位に集積し、「放射線誘発核内ドメイン」と呼ばれる高次構造体を形成することが知られています。
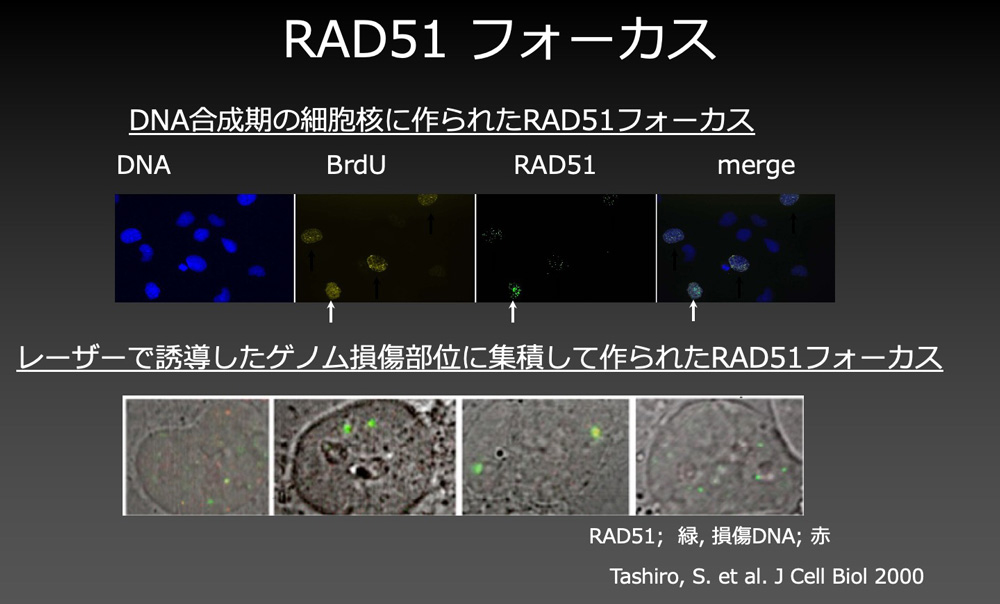
私たちは、放射線により誘導される最も重篤なDNA損傷であるDNA二本鎖切断の修復機構を明らかにするため、DNA二本鎖切断の相同組換え修復に関わるRAD51による放射線誘発核内ドメインRAD51フォーカス形成の分子機構の解明に取り組んできました。
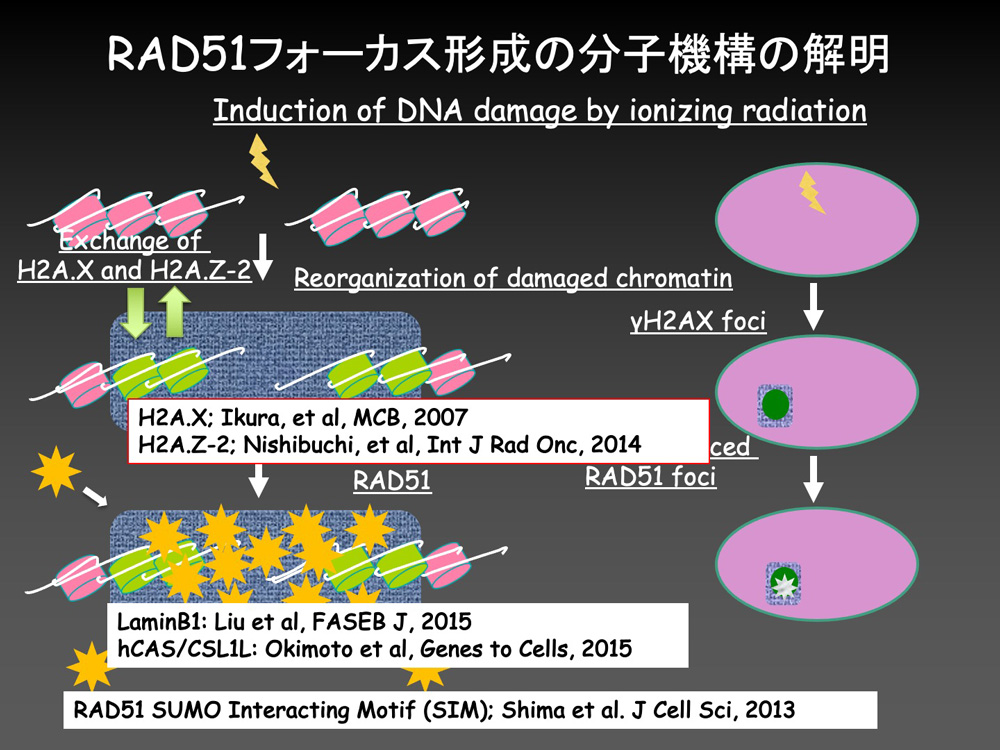
その結果、RAD51が損傷部位に集積してRAD51フォーカスを形成するためには、ヒストンH2AXやH2AZ-2の化学修飾による交換反応や、細胞核膜の裏打ちタンパク質LaminB1や細胞質と細胞核の間の輸送に関連するタンパク質、さらにはRAD51がSUMO化という化学修飾を受けたタンパク質との相互作用が必要であること、などを明らかにしてきました。
これらの研究から、私たちは、RAD51フォーカスなどの放射線誘発核内ドメインが放射線被ばくなどによる染色体異常の形成に深く関わっていると考えています。このため、最新の顕微鏡画像解析技術などを用いて、DNA損傷と関連する核内高次構造体の局在・動態を制御するメカニズムの解明に取り組んでいます。このような研究から、放射線障害の予防法や治療法、がんの新しい診断法や治療法の確立を目指しています。
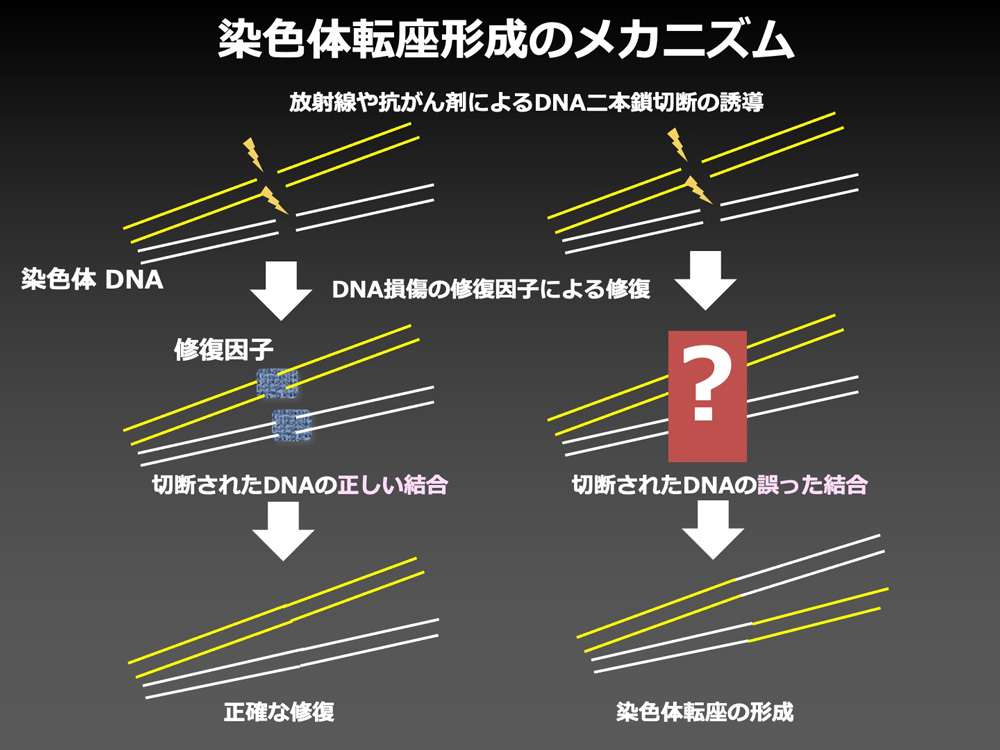
放射線や抗がん剤による染色体異常を防ぐ分子機構
放射線や抗がん剤などで切断された染色体DNAは、細胞に備わっているDNA二本鎖切断修復機構により修復されますが、その修復過程で切断端が誤った場所に繋がれると、染色体転座などの染色体の構造異常が形成されます。では、どうやって細胞は染色体構造異常を防いでいるのでしょうか?
この疑問を解決するために、私たちは抗がん剤エトポシドの治療が引き起こすことがある二次性白血病に特異的な11番染色体の異常をモデルに、染色体異常を防ぐ分子機構の解明に取り組みました。

その結果、DNA損傷シグナル制御因子ATMが、クロマチン構造変換複合体の構成因子であるARP8をリン酸化することで、修復因子の損傷DNAへの結合を適度に抑制していることがわかりました。すなわち、ATMは修復のアクセルとしての役割だけでなく、ブレーキとしても働くことで、修復の活性を適切なレンジに調整し、染色体異常を防いでいることが明らかになりました。
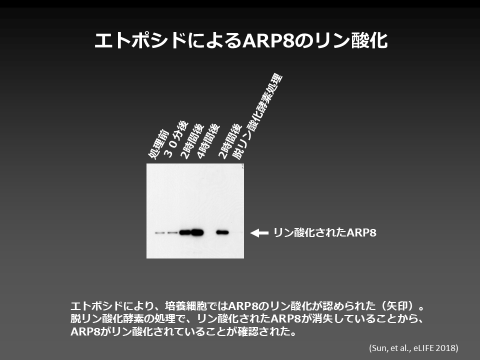
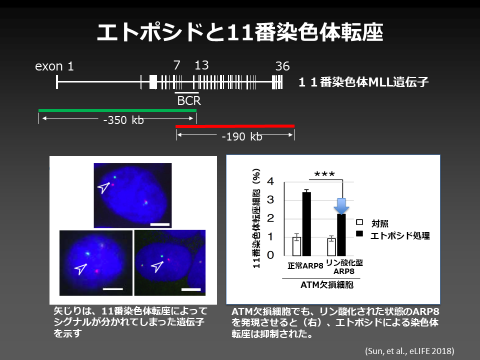
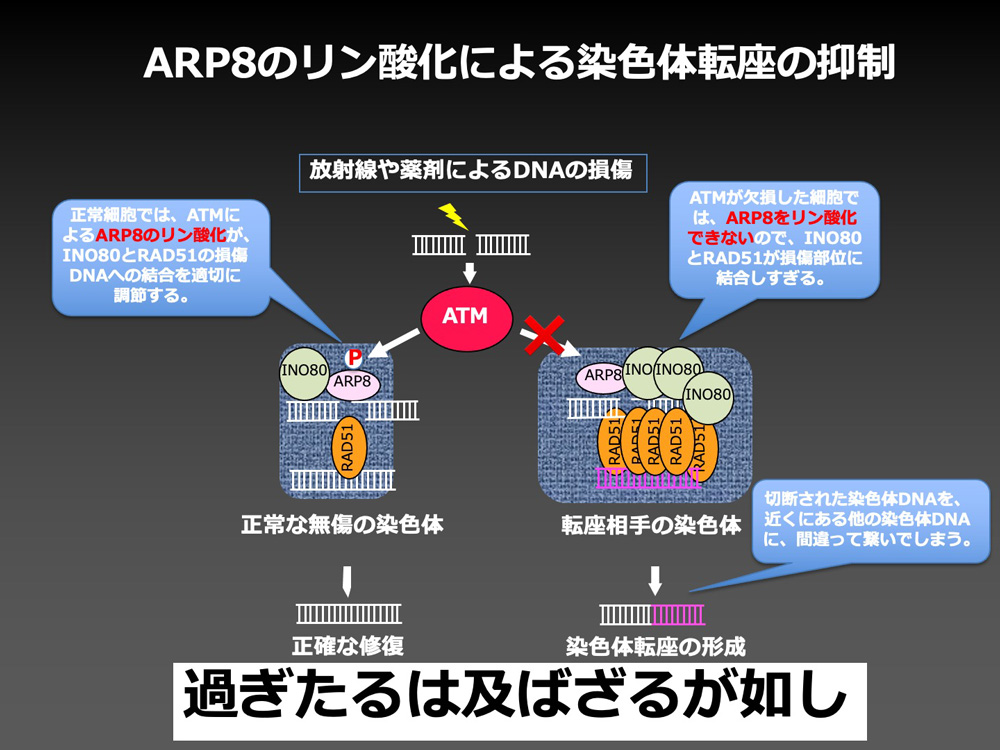
この研究成果は、正確なDNA修復をおこなうための重要な分子機構を明らかにしたもので、放射線被ばくや薬剤の後障害である白血病やがんの発症予防法の確立に繋がることが期待されます。
次世代の放射線医療開発に向けて
現代の医療では、病気の診断に放射線を使った診断法は欠かすことができないものです。特に、CT検査から得られる情報は、様々な病気のスクリーニング、診断、治療経過観察にとても有用です。しかし一方で、放射線は染色体DNAを傷つけ遺伝子の情報を変えてしまうことが発がんなど様々な健康障害につながるとされているため、CT検査の安全性が議論されています。
100 mSv以上の放射線の影響は、原爆被爆者の健康調査などによりある程度明らかになっていますが、CT検査のようにその10分の1程度の放射線の健康影響は非常に小さいので、100万人、1000万人などという非常に多くの人の放射線被ばくだけの影響を調査しないとわからないと考えられています。
そこで、私たちは染色体の異常を高感度に検出し、弱い放射線の体への影響を調べる方法の開発に取り組みました。通常の染色体の解析にはギムザ染色で染めた染色体標本が用いられますが、正確な解析を行うためには高度な訓練と経験が必要です。そこで、私たちはFISH法を用いて染色体の一部を赤色と緑色に染めることにより、染色体解析を効率的に行うことができる方法を開発しました。
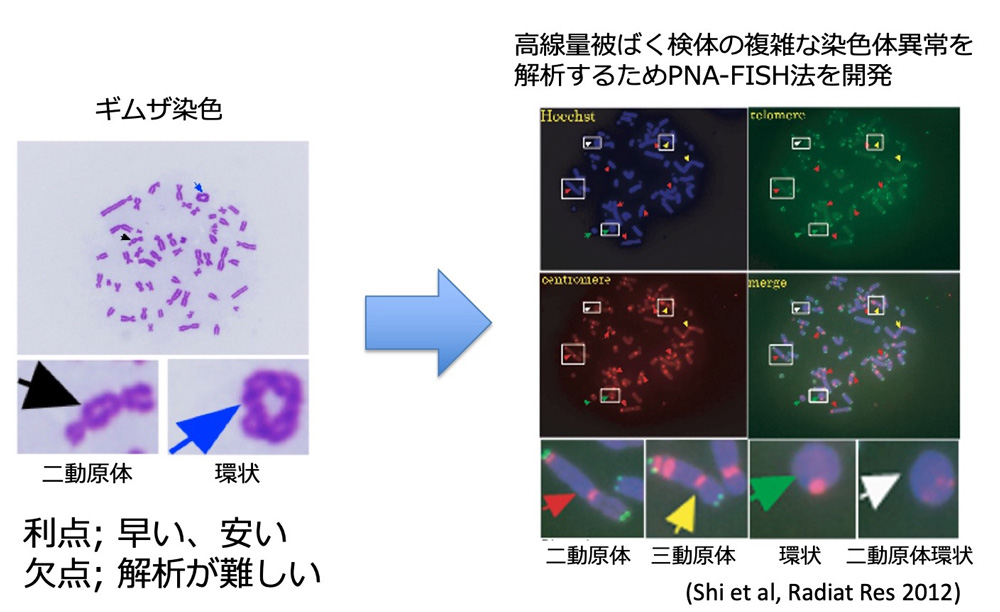
次に、この方法を使って、CT検査の影響が本当に検出できるのかを調べました。広島大学病院を受診された60名の癌ではない患者さんについて、CT検査の前後で血液細胞の染色体異常を調べました。その結果、この方法を使うことで、CT検査によって染色体異常が増加することを検出することが可能であることがわかりました。
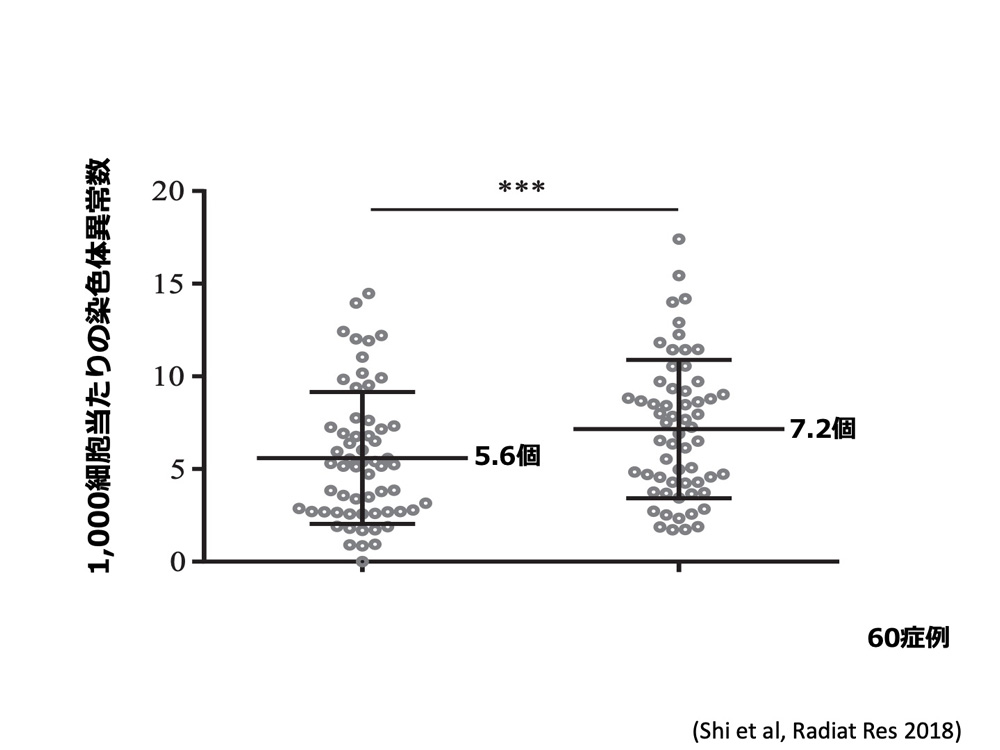
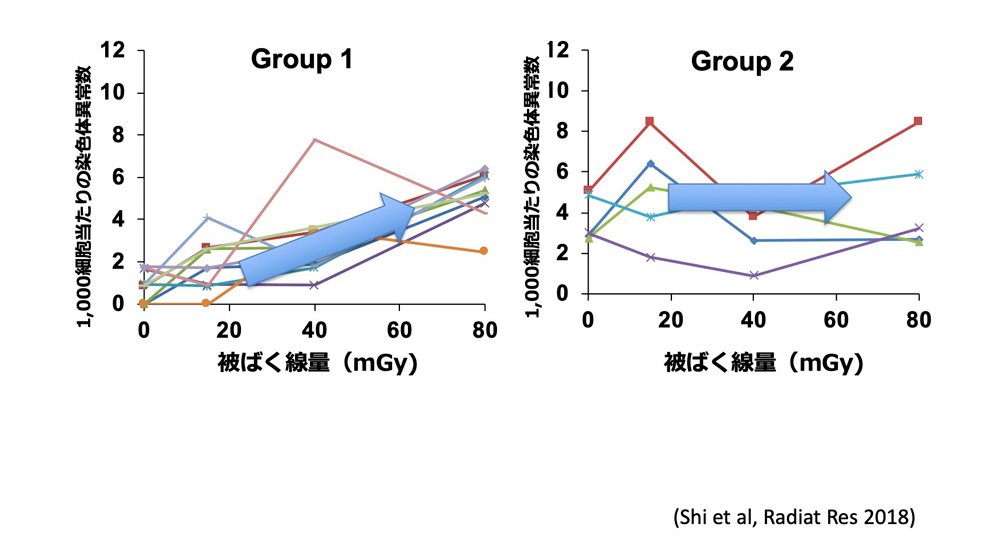
さらに、興味深いことに、人によっては同じ程度の被ばくを受けても染色体異常の増え方が異なること、すなわち個人差がある可能性が示されました。そこで、健康なボランティアから採取した血液に非常に弱い放射線を当てて染色体異常の増え方を調べてみると、被ばく線量と染色体異常の増加がよく相関する人たちと、低線量の被ばくではあまり染色体異常が増えない人たちがいることがわかってきました。今、どうして弱い放射線に対して染色体異常の増え方に個人差が生じるのか、を調べているところです。
最近のCT技術の進歩から、これまでより低い線量のCT検査でもきれいな画像が撮れるようになってきています。このような低線量CT検査を使った、リスクが高い人を対象とした肺がん検診は、死亡率を2割程度減少させることが報告され、注目されています。一方で、このような低線量CT検査でも、健康影響がどの程度あるのか、が議論されています。
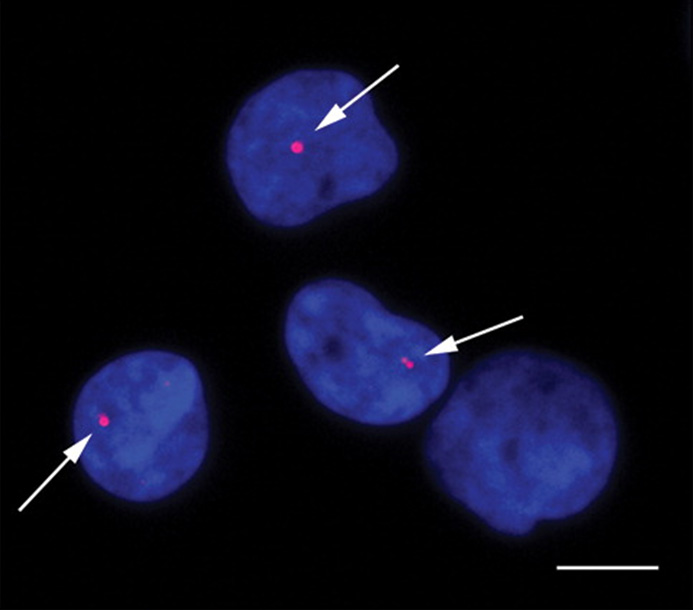
そこで、私たちは、低線量CT検査による染色体異常の増加を検討しました。今回は、染色体だけでなく、染色体DNAに傷が入った時にリン酸化という化学修飾を受けるヒストンタンパク質の一種H2AXのリン酸化も調べました。リン酸化されたH2AX(通称γH2AXと言います)は、DNA損傷があるところに集まってγH2AXフォーカスと呼ばれる核内ドメインを形成します。1つのγH2AXフォーカスには1つのDNA損傷が含まれる、とされているので、γH2AXフォーカスの数を顕微鏡で調べることにより、染色体DNAの傷を鋭敏に検出することができます。
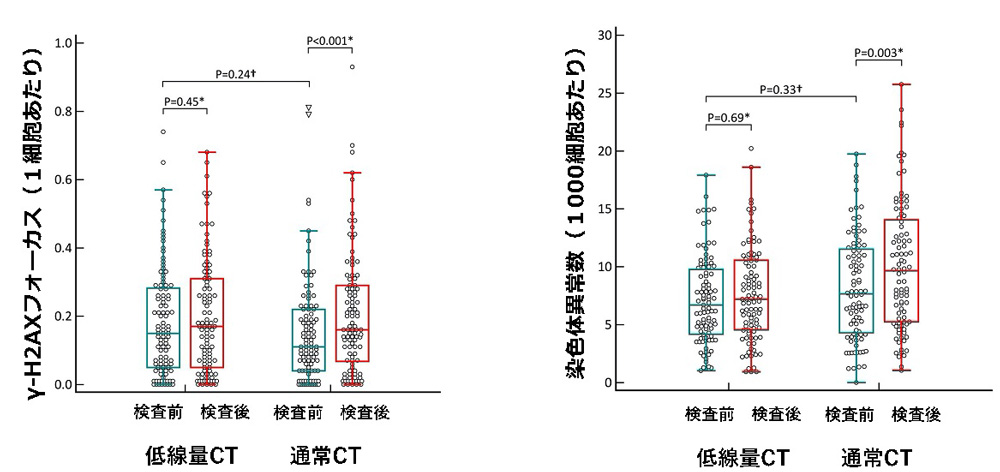
広島大学病院で、低線量CT検査と通常のCT検査を受けた症例で、検査の前後でのγH2AXフォーカスと染色体異常の数の変化を検討しました。その結果、通常のCT検査の前後では明らかなγH2AXフォーカスと染色体異常の増加が検出された一方、低線量CT検査の前後ではγH2AXフォーカスと染色体異常の増加は検出できませんでした。すなわち、低線量CT検査では、通常のCT検査の影響を明確に検出できる手法を用いてもわからないほどしか染色体DNAに傷が入らないことが明らかになりました。低線量CT検査による高リスクの方の肺がんのスクリーニングは死亡率を2割も低下させるほど有効な検査ですので、今回の研究結果は、肺がんスクリーニングでの低線量CT検査の正当化を支持するものと言えます。この研究結果は、2020年3月の米国放射線科領域の専門誌Radiology誌に掲載されました。
私たちは、これからもゲノム損傷などの放射線被ばくの影響を鋭敏に定量的に測定する技術を開発し、医療放射線をより有効に利用する「次世代の放射線医療」の開発に取り組んでいきます。


